■キンギョの全ゲノム配列を解読し、キンギョの形態、体色の多様性の謎に挑む。
キンギョには、眼が過剰に大きく成長するデメキンや背びれが無いランチュウなど、多くの体形や体色に関する遺伝的な変異体が存在しますが、それらを制御する遺伝子の実態はほとんど解析されていませんでした。キンギョの祖先種に全ゲノム重複という現象がおこって、遺伝子の総数が約2倍に増加したことにより、キンギョのゲノムの構造は一般の魚類よりも複雑で全ゲノムの解読が困難でした。私たちは、米国NIH、大阪大学、国立遺伝学研究所、愛知県水産試験場との共同研究により、ロングリード次世代DNAシーケンサーと雌性発生キンギョを使って全ゲノム配列の解読に成功しました。今後、キンギョ品種が持つ表現型を制御するメカニズムの解明が進むことが期待されます。また、キンギョ品種にはヒトの遺伝病と似た症状を持つものが知られており、ヒトの病気の原因究明にキンギョが役立つことも期待されます。

私たちの研究グループは米国NIH、国立遺伝学研究所、愛知県水産試験場との国際共同研究によりキンギョの標準型であるワキンの全ゲノム解読を行った。

キンギョはフナを原種とする観賞魚であるが、デメキンやランチュウなどの様々な形態や色を持つ品種が存在し、現在、世界で70以上の品種が飼育されている(図Omori & Kon JB 2018より改変)。これらの中には、眼球や骨格の形態など発生生物学的に興味深い表現型を持つものや、網膜変性疾患や骨形成異常などヒト疾患と関連する異常を持つものも多く存在する。
■キンギョ品種に見られる表現型の遺伝的基盤の解明
キンギョは、私たちヒトと同じ脊椎動物であり、体の形づくりや体色を決める遺伝子の多くが共通です。キンギョにはゼブラフィッシュやメダカなどで見られない表現型をもつ品種(変異体)が多数存在し、キンギョの表現型と関連する遺伝子を研究することで、脊椎動物の体の形や色を決めるメカニズムが明らかになると考えられます。また、キンギョにはヒトの遺伝病と似た特徴を持つ品種を疾患モデルとして研究することで、ヒトの遺伝病の発症機構を研究することができます。
キンギョ品種のひとつデメキンは少なくとも4種類の表現型
(出目、三ツ尾、黒い体色、短縮した背骨)を同時に持つ。
■キンギョの全ゲノム重複とゲノム進化メカニズムの理解
キンギョの原種であるフナの祖先種では1400万年前に全ゲノム重複(Whole Genome Duplication; WGD)と呼ばれるすべての遺伝子が倍加する現象が起こったことが、キンギョのゲノム解析により明らかとなりました。私たちヒトを含む脊椎動物でも約5億年前に2回の全ゲノム重複を経験したことがわかっており、キンギョの遺伝子を研究することで脊椎動物の進化の中で起こった全ゲノム重複のメカニズムを明らかにすることができます。私たちは、全ゲノム重複後の1400万年の間に非対称サブゲノム進化と呼ばれる特殊な変化がキンギョのゲノムに起こっていることを発見しており、その仕組みについて研究を進めています。また、コイやフナが進化の中で獲得した特性を環境適応進化の観点から研究を行っていいます。
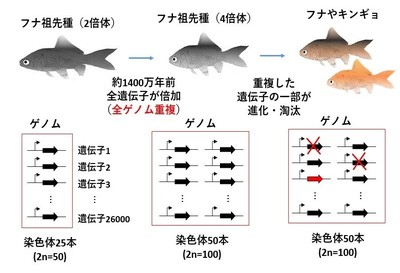
フナ(キンギョの原種)の祖先種では約1400万年前に全ゲノム重複が起こり、
その後、遺伝子が進化・淘汰されて現在のフナやキンギョのゲノムを構成している。
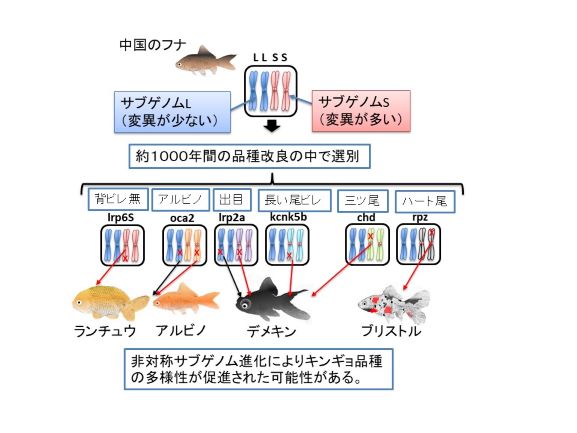
キンギョのゲノムには変異の多いサブゲノムSと変異の少ないサブゲノムLが存在する。このような現象を非対称サブゲノム進化と呼ひ、そのためにキンギョ品種には表現型の多様性が促進された可能性が考えられる。
■繊毛の長さは、どのような仕組みで決められているのか?
私達、ヒトを含めた脊椎動物の細胞では、体じゅうのほとんどの細胞が繊毛を持っているのですが、その繊毛の長さは、様々で、それぞれの細胞の機能に適応しています。例えば、精子の鞭毛は細胞体よりもはるかに長く100μm近くもあるのに対し、神経幹細胞の繊毛は、2~3μm程度しかありません。不思議なことに、繊毛の太さの方は、ほぼ一定です。この繊毛の長さはどのような仕組で決められているのでしょうか?私達は、繊毛の長さ制御の分子メカニズムを研究してきました。この中で、繊毛の長さ制御の仕組みに異常があると疾患を引き起こすことが明らかとなりました。
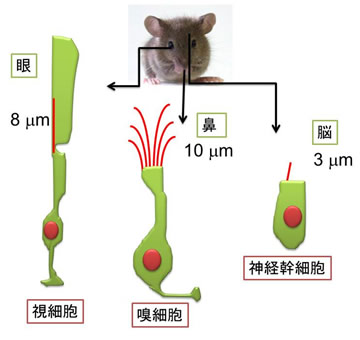
細胞の種類によって繊毛の長さは様々である。
■網膜視細胞の繊毛キナーゼMAKを欠損すると繊毛が長くなる
=網膜色素変性症が発症する新規なメカニズム==
私達の眼球の奥には、網膜という神経細胞のシートが張り付いており、ここに光センサー神経細胞である視細胞が存在し、光を感知しています。この視細胞が細胞死を起こすと視覚障害(網膜色素変性症)がおこり、失明に至ることもあります。網膜色素変性症の原因は、未だわかっていないことも多く、治療法は確立されていません。私たちは視細胞の研究を進める中でMak(Male germ cell kinase)という機能未知キナーゼが視細胞に高発現していることを見出しました(Omori et al., PlosOne 2010)。Makの遺伝子欠損マウスでは、ヒトの網膜色素変性症と同様に視細胞変性が起こり、視覚機能が低下しました(Omori et al., PNAS2010)。興味深いことに、Mak欠損マウスでは視細胞の繊毛が過剰に伸長していることが分かりました。また、Makが網膜色素変性症の原因遺伝子であるRP1をリン酸化し、繊毛の長さ制御を行うことを見出しました。このことから、繊毛の長さ制御が視細胞の生存に重要であることが明らかとなりました。最近、私達の研究を裏付ける形で、網膜色素変性症患者ゲノムの解析からMAKが網膜色素変性症の原因遺伝子のひとつであることが報告されています。
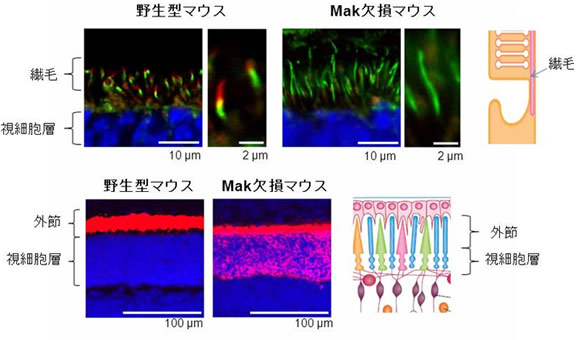
Mak欠損マウスの視細胞繊毛は野生型に比べて2倍以上長い(上段、緑:繊毛、赤:Mak)。
Mak欠損マウスでは視細胞の細胞体にロドプシン(赤)の蓄積が見られる(下段)。
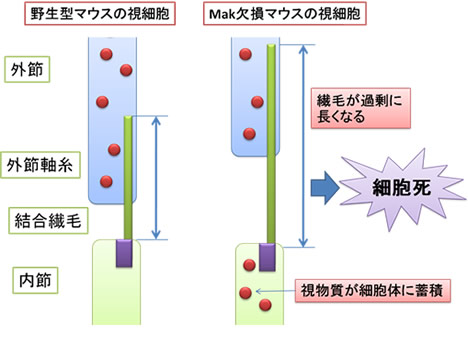
野生型マウスとMak欠損マウスの視細胞の違い
Mak欠損マウスでは、視細胞の繊毛が過剰に長くなり、
視物質が細胞体に蓄積することにより、視細胞が細胞死する。
ゼブラフィッシュelipsa変異体では繊毛が短くなる
=蛋白質の繊毛局在蛋白質が輸送される仕組み(intraflagellar transport, IFT)の研究=
繊毛では、キネシンやダイニンのモーターによって蛋白質の輸送が行われています。例えば、視細胞では、ロドプシンという光センサー分子がIFTによって運ばれることが知られています。ロドプシンの局在異常は網膜色素変性症が発症する原因となるので、その分子メカニズムを研究することは重要です。私たちは、ゼブラフィッシュ変異体の研究から、IFTに関与する分子メカニズムを解明してきました。ゼブラフィッシュ変異体エリプサ(elipsa)では、視細胞が細胞死をおこし、ヒトの網膜色素変性症と類似した視細胞の脱落が見られます。興味深いことに、エリプサ変異体ではMak欠損マウスとは逆に視細胞の繊毛が短くなっていました。私たちは、エリプサの原因遺伝子を特定し、この遺伝子産物がGTPaseであるRab8と間接的に相互作用することで、視細胞の蛋白質輸送を担っていることを見出してきました(Omori et al.., Nature Cell Biology 2008)。このことから、エリプサは視細胞の繊毛の長さ調節をするとともに、繊毛への蛋白質輸送を行う重要な因子であることが明らかとなりました。
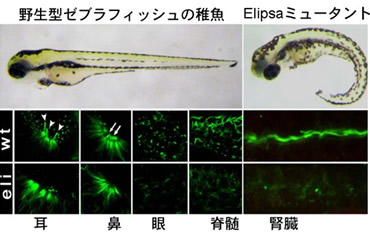
ゼブラフィッシュ・エリプサ(Elipsa)変異体は体軸の湾曲を示す(上段)。
アセチル化チューブリン(緑)により繊毛を染色したところ、エリプサでは感覚器官や
腎臓などで繊毛が短くなる(下段)。

